- Introducción
- 4.1 Conceptos y Definiciones
- 4.2 Escalas de Temperatura
- 4.3 Capacidad Calorífica
- 4.4 Leyes de la Termodinámica
- Conclusión
- Referencias Bibliográficas.
Introducción a la Termodinámica
Instituto Tecnológico de Matheuala
domingo, 27 de noviembre de 2011
Indice
Introducción
Introducción
La termodinámica es una rama fundamental de la Química y Física, que se centra en el estudio macroscópico de la naturaleza en equilibrio, sin embargo resulta en la mayoría de los casos muy poco popular entre los estudiantes.
Esto puede ser debido a que el estudio termodinámico de un proceso quimicofísico se suele abordar mediante un planteamiento matemático muy riguroso, donde la derivación de todas las ecuaciones tiene un peso importante con lo que el estudiante pierde la visión macroscópica del fenómeno estudiado.
La idea de esta página y de su contenido es acercar al estudiante a los procesos en sí, y mediante ejemplos sencillos facilitarle el aprendizaje de la materia. No se ha tratado de escribir unos apuntes que sustituyan a los muchos y buenos textos de Termodinámica Química existentes, sino de complementarlos, y hacerlo de forma esquemática. Ciertamente, se requerirán unos conocimientos matemáticos básicos, pero la termodinámica es una ciencia macroscópica y nosotros, no hay que olvidarlo, hablaremos de propiedades medibles.
Esto puede ser debido a que el estudio termodinámico de un proceso quimicofísico se suele abordar mediante un planteamiento matemático muy riguroso, donde la derivación de todas las ecuaciones tiene un peso importante con lo que el estudiante pierde la visión macroscópica del fenómeno estudiado.
La idea de esta página y de su contenido es acercar al estudiante a los procesos en sí, y mediante ejemplos sencillos facilitarle el aprendizaje de la materia. No se ha tratado de escribir unos apuntes que sustituyan a los muchos y buenos textos de Termodinámica Química existentes, sino de complementarlos, y hacerlo de forma esquemática. Ciertamente, se requerirán unos conocimientos matemáticos básicos, pero la termodinámica es una ciencia macroscópica y nosotros, no hay que olvidarlo, hablaremos de propiedades medibles.
4.1 Definiciones
Conceptos y Definiciones
Termodinámica: Rama de la mecánica teórica que estudia la transformación del movimiento en calor y viceversa. No sólo se preocupa de la velocidad de difusión del calor, como una interpretación simple del termino podría sugerir, sino que también, a través de ecuaciones cuánticamente descriptivas, de los cambios físicos o químicos producidos cuando una sustancia absorbe calor e, inversamente, la evolución de calor cuando ocurren cambios físicos o químicos.
Sistema (Termodinámico): región restringida, no necesariamente de volumen constante o fija en el espacio, en donde se puede estudiar la transferencia y transmisión de masa y energía. Todo sistema tiene límites que pueden ser reales o imaginarios.
- Sistema aislado: No permite intercambio de materia ni energía (s. aislado adiabáticamente: No permite intercambio de calor)
- Sistema cerrado: No permite intercambio de materia, pero sí de energía.
- Sistema abierto: Permite intercambio de materia y energía.
- Sistema químico: Las interacciones sólo se deben a presiones, es decir, se excluye la precedencia de campos, o la posibilidad de efectuar trabajo eléctrico, magnético, de superficie, etc.

Variables Termodinámicas: O coordenadas del sistema, son aquellas que definen estado (conjunto de propiedades que caracterizan al sistema). Existen dos tipos:
- a) Variables físicas: Las fundamentales son Presión (P), Volumen (V) y Temperatura (T); P y T son variables intensivas (independientes del tamaño del sistema) y V es extensiva (depende del tamaño del sistema).
- b) Variables Químicas: Usualmente se utilizan los números de moles de cada componente. En rigor, a la termodinámica le interesan más los potenciales químicos.
4.2 Escalas de Temperatura
La temperatura es el nivel de calor en un gas, líquido, o sólido. Tres escalas sirven comúnmente para medir la temperatura. Las escalas de Celsius y de Fahrenheit son las más comunes. La escala de Kelvin es primordialmente usada en experimentos científicos.
Escala Celsius
La escala Celsius fue inventada en 1742 por el astrónomo sueco Andrés Celsius. Esta escala divide el rango entre las temperaturas de congelación y de ebullición del agua en 100 partes iguales. Usted encontrará a veces esta escala identificada como escala centígrada. Las temperaturas en la escala Celsius son conocidas como grados Celsius (ºC).
Escala Fahrenheit
La escala Fahrenheit fue establecida por el físico holandés-alemán Gabriel Daniel Fahrenheit, en 1724. Aun cuando muchos países están usando ya la escala Celsius, la escala Fahrenheit es ampliamente usada en los Estados Unidos. Esta escala divide la diferencia entre los puntos de fusión y de ebullición del agua en 180 intervalos iguales. Las temperaturas en la escala Fahrenheit son conocidas como grados Fahrenheit (ºF).
Escala de Kelvin
La escala de Kelvin lleva el nombre de William Thompson Kelvin, un físico británico que la diseñó en 1848. Prolonga la escala Celsius hasta el cero absoluto, una temperatura hipotética caracterizada por una ausencia completa de energía calórica. Las temperaturas en esta escala son llamadas Kelvins (K).
Cómo Convertir Temperaturas
A veces hay que convertir la temperatura de una escala a otra. A continuación encontrará cómo hacer esto.
- Para convertir de ºC a ºF use la fórmula: ºF = ºC x 1.8 + 32.
- Para convertir de ºF a ºC use la fórmula: ºC = (ºF-32) ÷ 1.8.
- Para convertir de K a ºC use la fórmula: ºC = K – 273.15
- Para convertir de ºC a K use la fórmula: K = ºC + 273.15.
- Para convertir de ºF a K use la fórmula: K = 5/9 (ºF – 32) + 273.15.
- Para convertir de K a ºF use la fórmula: ºF = 1.8(K – 273.15) + 32.
4.3 Capacidad Calorífica
Capacidad calorífica
La capacidad calórica es la cantidad de calor que permite variar, en un grado, la temperatura de un cuerpo. Expresada en fórmula: 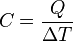 donde: C = capacidad calórica; Q = cantidad de calor; ΔT = variación de temperatura
donde: C = capacidad calórica; Q = cantidad de calor; ΔT = variación de temperatura
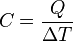 donde: C = capacidad calórica; Q = cantidad de calor; ΔT = variación de temperatura
donde: C = capacidad calórica; Q = cantidad de calor; ΔT = variación de temperatura
El calor específico es la cantidad de calor cedido o absorbido por un gramo de una sustancia, para variar su temperatura en un grado Celsius.  donde: c = calor específico; C = capacidad calórica; m = masa
donde: c = calor específico; C = capacidad calórica; m = masa
 donde: c = calor específico; C = capacidad calórica; m = masa
donde: c = calor específico; C = capacidad calórica; m = masa
y el calor necesario para producir un cierto aumento de temperatura es
Q = cmΔT
A continuación a manera de ejemplo esta el siguiente vídeo donde explican la capacidad calorífica del agua.
4.4 Leyes de la Termodinámica.
Primera ley de la termodinámica
También conocida como principio
de conservación de la energía para la termodinámica «en realidad el primer
principio dice más que una ley de conservación», establece que si se realiza
trabajo sobre un sistema o bien éste intercambia calor con otro, la energía
interna del sistema cambiará. Visto de otra forma, esta ley permite definir el
calor como la energía necesaria que debe intercambiar el sistema para compensar
las diferencias entre trabajo y energía interna. Fue propuesta por Nicolas
Léonard Sadi Carnot en 1824, en su obra Reflexiones sobre la potencia motriz
del fuego y sobre las máquinas adecuadas para desarrollar esta potencia, en la
que expuso los dos primeros principios de la termodinámica. Esta obra fue
incomprendida por los científicos de su época, y más tarde fue utilizada por
Rudolf Loreto Clausius y Lord Kelvin para formular, de una manera matemática,
las bases de la termodinámica.
La ecuación general de la
conservación de la energía es la siguiente:
Que aplicada a la termodinámica
teniendo en cuenta el criterio de signos termodinámico, queda de la forma:
Donde U es la energía interna del
sistema (aislado), Q es la cantidad de calor aportado al sistema y W es el
trabajo realizado por el sistema.
Esta última expresión es igual de
frecuente encontrarla en la forma ∆U = Q + W.
Segunda ley de la termodinámica
Esta ley arrebata la dirección en
la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la
imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una
mancha de tinta dispersada en el agua pueda volver a concentrarse en un pequeño
volumen). También establece, en algunos casos, la imposibilidad de convertir
completamente toda la energía de un tipo en otro sin pérdidas. De esta forma,
la segunda ley impone restricciones para las transferencias de energía que
hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el Primer
Principio. Esta ley apoya todo su contenido aceptando la existencia de una
magnitud física llamada entropía, de tal manera que, para un sistema aislado
(que no intercambia materia ni energía con su entorno), la variación de la
entropía siempre debe ser mayor que cero.
Debido a esta ley también se
tiene que el flujo espontáneo de calor siempre es unidireccional, desde los
cuerpos de mayor temperatura hacia los de menor temperatura, hasta lograr un
equilibrio térmico.
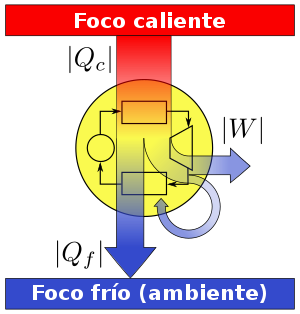
La aplicación más conocida es la
de las máquinas térmicas, que obtienen trabajo mecánico mediante aporte de
calor de una fuente o foco caliente, para ceder parte de este calor a la fuente
o foco o sumidero frío. La diferencia entre los dos calores tiene su
equivalente en el trabajo mecánico obtenido.
Tercera ley de la termodinámica
La Tercera de las leyes de la termodinámica, propuesta por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto.
Conclusión
La Termodinámica se ocupa de estudiar procesos y propiedades macroscópicas de la materia y no contiene ninguna teoría de la materia.
Referencias
Física, Dinámica, Estática & Termodinámica
Universidad Autónoma de Nuevo León
Autor: Jose Luis Aguisar Nava
Instituto de Física del plasma
http://www.lfp.uba.ar/new/index.html
Wikipedia.
Conclusión
La Termodinámica es el estudio de las propiedades de sistemas de gran escala en equilibrio en las que la temperatura es una variable importante.
Varios términos que hemos usado aquí: sistemas, equilibrio y temperatura serán definidos rigurosamente más adelante, pero mientras tanto bastará con su significado habitual.
En la Termodinámica hay dos leyes básicas, y ambas se pueden enunciar de modo de negar la posibilidad de ciertos procesos.
La Primera Ley establece que es imposible un proceso cíclico en el cual una máquina produzca trabajo sin que tenga lugar otro efecto externo, es decir niega la posibilidad de lo que se suele llamar “máquina de movimiento perpetuo de primera especie”.
La Segunda Ley no se puede enunciar de modo tan preciso como la primera sin una discusión previa. Sin embargo, hecha la salvedad que ciertas definiciones se deben dar todavía, podemos decir que la Segunda Ley establece que es imposible un proceso cíclico en el cual una máquina realice trabajo intercambiando calor con una única fuente térmica.
Referencias
Física, Dinámica, Estática & Termodinámica
Universidad Autónoma de Nuevo León
Autor: Jose Luis Aguisar Nava
Instituto de Física del plasma
http://www.lfp.uba.ar/new/index.html
Wikipedia.
Suscribirse a:
Entradas (Atom)